
国家药监局已经发布执行UDI标准一段时间了。但是还是有很多器械行业的执行者还没能很好的理解UDl的合规执行和让项目在生产中落地实施。
溯印-弥特科技作为UDl的施行项目落地方案解决方。再次为您把执行细节由头到尾再次表述一次。
登录医疗器械唯一标识数据库。
1.医疗器械注册证(注册人申报)
医疗器械唯一标识管理信息系统为注册人/备案人提供三种数据申报途径。
网页填报:注册人/备案人登录系统后,直接在网页填报提交。
批量导入:注册人/备案人登录系统后,下载系统提供的数据模板,注册人/条室人按照要求准备好数据,再通过数据模版批量导入功能批量导入数据,模板请参考:《医疗器械唯一标识信息系统数据导入模板v2-20200903》
申报接口:系统提供API接口申报数据。具体要求见“数据接口说明”栏目。
国务院颁发《医疗器械监督管理条例》,规定了第一类医疗器械施行产品备案管理;第二类、第三类医疗器械施行产品注册管理(分类表请有右手边,点击在线咨询领表)。按管理分类提供材料快速注册。
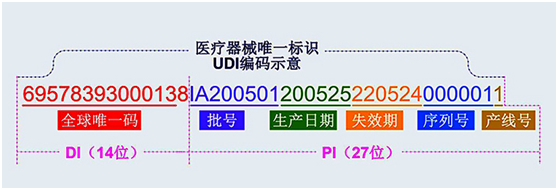
2.数据申报
3.数据对接
申报方通过接口对接数据,适用于流通机构、医疗机构等数据共享方等通过接口获取数据。以上相关方应仔细阅读以下文档,以帮助开展相。对接工作。(细节跟不上,请点击右手边在线咨询寻求协助)
4.选择发码合作机构(共计三家)适应国际流通的两家,实惠适应国内流通的一家。
5.机构用码成员注册,填写Dl数据申报(细节跟不上,请点击右手边在线咨询寻求协助)
6.根据实际生产需求和设备对接数据上传方式,用溯印-弥特软件批量生成P编码,人工或者设备全自动赋码及上传到指定数据链接平台。于其为了项目落实挠破头。不如开口问一问。溯印-弥特科技作为国家药监局选择推送的UDI落地实施技术服务支持企业。很高兴为你们服务。

